美 스탠포드의대 연구진, “44세와 60세에 급격한 노화 겪어”

▲ 역사는 하루아침에 이뤄지지 않아도 노화는 가능하다.
인간은 서서히 늙는 것이 아니라 인생에서 두 번, 급격히 늙는 시기가 있다는 연구 결과가 나왔다.
ⓒGettyImages
요즘 들어 부쩍 늙었다는 기분이 들었다면, 주목하자. 단순히 기분
탓이 아닐지도 모른다.
미국 스탠포드 의대 연구진의 지난 14일 국제학술지 ‘네이처 노화(Nature Aging)’에 발표한 새로운 연구에 따르면 우리 몸의 노화는 공평하지 않다.
44세와 60세는 우리 몸의 많은 분자와 미생물들이 급격하게 증가하거나 감소하는 현상이 나타난다.
인간은 인생에서 두 번 급 늙는다
노화의 원인은 다양하다.
(관련 기사 보러 가기 –과학자들이
말하는 ‘늙음’의 진짜 원인) 하지만 전 연령에 걸쳐 공평하지는 않다.
노화 관련 질병 발생 위험이 특정 시점에 가속화된다는 점이 이를 증명한다.
일례로 미국의 의료 통계를 살펴보면, 파킨슨병 및 알츠하이머병과 같은 신경퇴행성 질환의 유병률은 노화와 함께 전반적인 증가 추세를 보이지만, 40세와 65세 경에 뚜렷한 증가를 보인다.
2019년 국제학술지 ‘네이처 메디신(Nature Medicine)’에 실린 연구에서는
인생에서 세 번의 급격히 늙는 시기를 특정했다.
바로 34세, 60세, 78세다.
이 연구에서 연구진은 혈액 속 단백질의 나이에 따른 수치 변화를 살폈는데, 위의 세 나이에서 단백질 수치가 급격히 변했다.
생체 활동에 뭔가 큰 변화가 생겼다는 의미다.
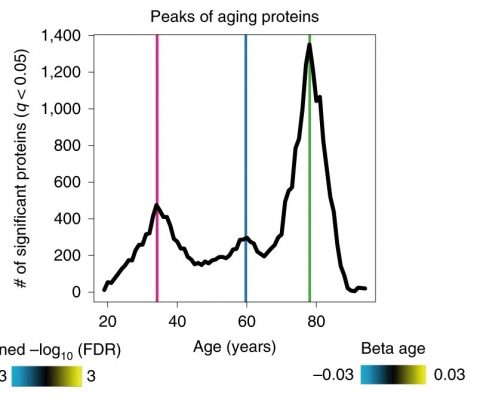
▲ 연령에 따른 혈액 속 단백질 변화를 살핀 2019년 ‘Nature Medicine’ 연구에서는 34, 60, 78세에 급격한 노화를 겪는다고 결론 내렸다.
ⓒNature Medicine
노화의 원인은 여러 가지인 만큼, 마이클 스나이더 미국 스탠포드대
의대 연구진은 더 다양한 데이터를 살피기로 했다.
연구진은 25~75세의 건강한 성인 108명의 혈액과 대변을 비롯해 피부, 구강, 비강에서 면봉으로 채취한 표본을 분석했다.
참가자들은 3~6개월 간격으로 표본 채취를 진행했으며, 짧게는 1.7년간 길게는 6.8년간 연구에 참여했다.
연구진은 기증받은 표본에서 RNA, 단백질, 대사산물 등 13만 5,239종의
다양한 생체 분자와 장과 피부에 서식하는 미생물 군집의 연령에 따른 변화를 추적했다.
결과는 놀라웠다.
인간의 노화에 따라 서서히 변하는 분자는 전체 데이터 중 단 6.6%에 불과했다.
대부분(81%)의 분자는 44세와 60세에 두 차례에 걸쳐 급격한 변화를 겪었다.
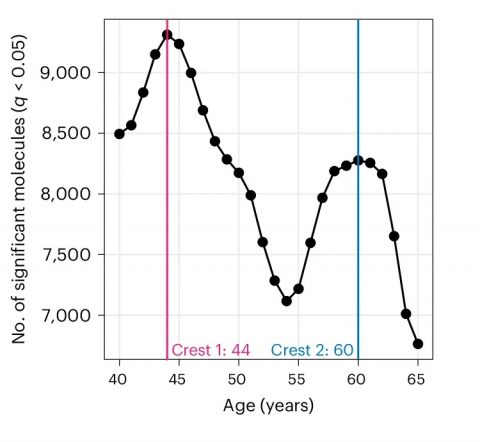
▲ 미국 스탠포드대 의대 연구팀은 노화와 관련된 분자의 수가 44세와 60세에 급격한 변화를 겪는다고 보고했다.
ⓒNature Aging
스나이더 교수는 “시간이 흐르며 자연스럽게, 점진적으로 늙는 것이
아니라 극적인 변화가 일어나는 시기가 있다”며 “우리가 연구한 대부분 종류의 분자는 그 시기를 40대 중반과 60대 초반으로 지목한다”고 설명했다.
40대 중반엔 알코올, 60대 초엔 탄수화물 조심
연구진이 특정한 두 시기에는 카페인 대사, 심혈관 질환, 피부 및
근육과 관련된 분자에 큰 변화가 나타났다.
각 시기에 특히 ‘많이 늙는’ 요소들도 있었다.
44세에는 알코올과 지질 대사와 관련된 분자 수에 큰 변화가 있었으며, 60세에는 탄수화물 대사, 신장 기능, 면역 조절 관련 분자의 변동 폭이 컸다.
두 시기에 특히 변화가 두드러진 이유에 대해서는 추가 연구가 필요하다.
다만 연구진은 이 연령대에서 일반적으로 나타나는 생활 습관이나 행동 요인도 연관될 것으로 보고 있다.
가령, 40대 중반 사람들은 스트레스를 많이 받는 시기이기 때문에, 알코올 소비가 증가하고 이에 따라 알코올 대사 기능 저하가 가속화되는 식이다.
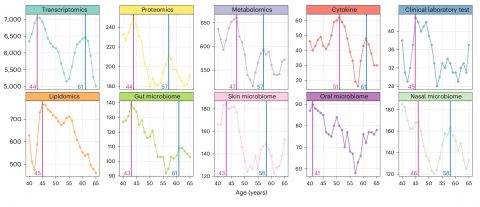
▲ 전사체, 단백질체, 대사산물, 사이토카인, 미생물 등 분자의 연령에 따른 변화. ⓒNature Aging
변동 원인에 대해서는 추가 연구가 진행될 테지만, 이번 연구는 원인이
무엇이든 40대와 60대에 건강에 더 많은 주의를 기울여야 함을 시사한다.
이 시기에는 심장을 보호하고 근육량을 유지하기 위해 운동량을 늘리거나, 알코올 대사 능력이 느려지는 40대에는 알코올 소비를 줄이는 것이 좋다.
스나이더 교수는 “이번 연구는 실험 참가자들의 커피나 알코올 섭취,
신체 활동 정도 등 생활습관까지 담지 못했다는 한계가 있다”면서도 “인생에서 두어번 노화가 급격히 진행된다는 점을 확실한 것으로 이 시기가 다가오기 전, 건강할 때 생활 방식을 바꿔야 한다”고 조언했다.
- 권예슬 리포터
- yskwon0417@gmail.com
과학자들이 말하는 ‘늙음’의 진짜 원인(1)
[과학자들이 말하는 ‘늙음’의 진짜 원인] DNA와 관련된 노화의 원인…유전체 불안정성, 텔로미어 마모, 후성 유전적 변화

▲ 과학자들은 노화의 원인을 규명하고, 이를 토대로 노화를 막는 치료법을 개발하기 위한 연구를 진행하고 있다.
ⓒGettyImages
나이는 숫자에 불과한 것만은 아니다.
숫자가 올라갈
때 우리 몸은 노화하고 있다.
비단, 체력이 떨어지고, 주름이 생기고, 피부 탄력이 떨어지는 것만을 의미하지 않는다.
노화에 대한 과학적 정의는 조금 더 매정하다.
‘생리학적으로 온전했던 상태가 점진적으로 망가져 기능에 문제를 일으키고, 죽을 가능성을 높이는 것’으로 정의된다.
과학자들은 눈에 보이는 노화의 기저에 있는 생물학적 노화의 특징들을 찾아내고 있다.
인간을 포함한 다양한 개체, 특히 포유류의 노화에서 나타나는 공통적인 특징들을 정리하면 반대로 노화를 막는 연구도 가능해진다.
생물학 분야 최고 권위의 국제학술지 ‘셀(Cell)’은 2013년
‘노화의 특징(The Hallmarks of Aging)’이라는 제목의 논문을 발표하며 생물학적 노화의 9가지 특징을 정리했다.
이후 10년간 추가된 연구를 종합하여 지난 1월 ‘노화의 특징: 확장판’을 다시 펴냈다.
여기에는 12개의 특징이 담겼다.
사이언스타임즈는 4편의 기사를 통해 노화의 생물학적 특징을 소개해보고자 한다.
노화의 원인 1: 유전체 불안정성

▲ 자외선, X선, 각종 화합물 및 활성산소로 인한 유전체 손상은 노화의 원인 중 하나다.
ⓒGettyImages
노화를 세포 수준에서 정의하자면, 정상적이지 못한 세포들이
제거되지 않고 비정상적으로 계속 활동하는 현상이다.
세포가 분열할 때 모든 유전정보가 새로운 세포로 전달된다면, 세포의 비정상적인 활동은 나타나지 않는다.
하지만 모든 유전정보를 담은 DNA에 변형이 생기면 세포 손상이 유발된다.
유전체 불안정성, 텔로미어 마모, 후성 유전학적 변화 등 세 가지가 DNA와 관련된 노화의 원인으로 정의된다.
강력한 태양 빛 아래서 서핑을 즐기는 것이 취미이던 일본의
‘꽃미남’ 배우가 급격히 노화된 모습으로 ‘역변’한 사진을 많이들 본 적 있을 것이다.
‘유전체 불안정성’은 자외선이나 X선, 각종 화합물, 활성산소 때문에 유전체가 손상되는 현상이다.
DNA가 손상되면 우리 몸속 단백질이 제대로 만들어지지 않거나, 이상한 단백질(돌연변이)가 만들어진다.
단백질은 호르몬을 만들고, 외부에서 나쁜 물질이 들어왔을 때 이를 퇴치하고, 유전자 손상을 감시하는 역할도 한다.
그리고 유전자의 손상이 감지되면 즉시 DNA 손상을 복구시켜 안정성을 유지하기도 한다.
나이든 생명체의 체세포에는 돌연변이를 비롯한 다양한 형태의
DNA와 염색체 손상이 축적된다.
이러한 손상은 중요한 기능을 하는 유전자나 회로에 문제를 만들어, 세포의 기능에 심각한 장애를 일으킨다.
쥐의 DNA 수리 기능을 망가뜨리면 노화 속도가 증가한다는 연구결과가 있으며, 인간 조로증 환자의 경우 DNA 수리 기작에 문제가 있다는 보고도 있다.
세포가 강력한 자외선에 쏘였다고 하더라도, 정상적인 세포라면
DNA 손상이 복구되기 때문에 유전자 불안정성은 제거된다.
하지만 DNA 손상이 과다하거나, 손상 복구에 관여하는 단백질에 문제가 있다면 변형된 DNA는 그대로 유지되며, 정상적인 세포와는 다른 모습을 보이게 된다.
즉, 유전체 불안정성은 세포의 변형을 유발하는 노화의 근본적인 원인으로 분류된다.
노화의 원인 2 : 텔로미어 마모
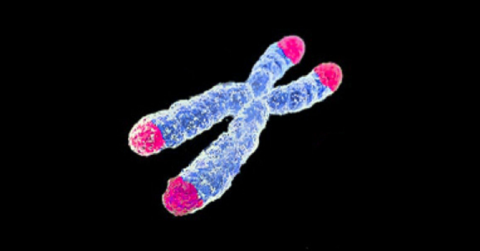
▲ 텔로미어는 DNA 묶음 끝 부위를 의미하는데, 이 부분이 마모되면 노화에 직결된다.
ⓒWikimedia
DNA 손상은 나이가 들며 축적되지만, 염색체의 끝 부위인
텔로미어(Telomere)는 특히 손상에 민감하다.
DNA가 실이라면, 텔로미어는 신발 끈 끝 부분의 코팅된 부분에 비유할 수 있다.
텔로미어는 세포분열 횟수가 증가(노화)함에 따라 그 길이가 점점 줄어든다.
코팅된 부분이 사라진 신발 끈이 쉽게 풀어지는 것으로 생각하면 쉽다.
텔로미어 마모는 유전체 불안정성보다 노화에 직결된다.
세계 최초로 체세포 복제 방식으로 복제된 동물인 복제 양 돌리가 이를 여실히 보여주는 사례다.
당시 돌리는 6세 정도 된 양의 체세포를 복제해 태어났다.
양의 평균 수명이 12년인 데 반해, 복제는 6년밖에 살지 못했다.
이미 텔로미어 길이가 소진되어있기 때문이다.
이렇게 외부에서 배양된 세포가 제한된 분열 능력을 가지는 현상을 ‘헤이플릭 한계’라고 부른다.
인간과 쥐 모두에서 나이 듦에 따라 텔로미어 길이가 짧아지는
것이 관찰됐다.
이를 역이용해 노화를 늦추는 연구도 진행됐다.
세포에 텔로미어를 유지할 수 있는 효소인 ‘텔로머레이즈’를 외부에서 주입해 발현시키면, 무한한 분열 능력을 갖게 된다.
노화의 원인 3 : 후성 유전적 변화

▲ 일란성 쌍둥이가 성장하며 서로 다른 모습을 보이는 것처럼, 다양한 외부 요인에 의한 후성 유전적 변화도 노화의 원인이다.
ⓒGettyImages
같은 유전 정보를 가지고 태어난 일란성 쌍둥이라도 나이가
들면서 차이가 나타난다.
단순히 패션이나 머리 스타일이 아니라 뚜렷하게 구분되는 모습의 차이가 생긴다.
이처럼 같은 유전 정보를 가지고 있더라도, 외부 요인에 의해 달라지는 변화를 후성 유전적 변화라고 한다.
다양한 후성 유전적 변화는 전 생애에 걸쳐 모든 세포와
조직에 영향을 미친다.
가령, 섭취한 약은 DNA와 결합하여 작동하는데, 이런 작은 변화가 유전정보가 해석되는 과정에 관여하여 후성 유전적 변화를 유발할 수 있다.
또, 미세먼지 등 환경오염 때문에 후성 유전적 변화가 생기기도 한다.
서로 다른 유전정보를 가진 부부가 함께 생활하면서 닮아가는 것도 후성 유전적 변화의 결과라고 볼 수 있다.
이런 후성 유전적 변화는 세포의 변형을 유도하는데, 이
변형이 세포 노화의 시작이다.
하지만 DNA에 발생하는 돌연변이와 달리 후성 유전적 변화는 되돌릴 수 있다.
후성 유전적 변화를 억제하는 물질을 이용하면 항 노화제를 개발할 수 있다는 의미다.
게다가, 후성 유전적 특징이 세대를 넘어 전달되는 현상도 대표적인 실험동물인 예쁜 꼬마선충을 이용한 연구에서 밝혀졌다.
부모 세대에서 특정 염색질 표지를 조절하면, 그 효과가 자손으로도 이어질 수 있다는 의미다.
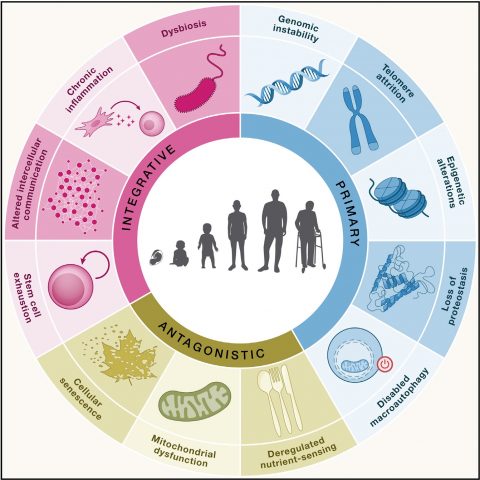
▲ 2023년 국제학술지 ‘Cell’이 제시한 노화의 12가지 특징. 이번 기사에서는 유전체 불안정성(Genomic instability), 텔로미어 마모(Telomere attrition), 후성 유전적 변화(Epigenetic alterations)에 대해 다뤘다.
ⓒCell
과학자들이 말하는 ‘늙음’의 진짜 원인(2)
[과학자들이 말하는 ‘늙음’의 진짜 원인] 단백질 항상성 상실, 영양소 감지능력 감소, 미토콘드리아 기능 장애

▲ 과학자들은 노화의 원인을 규명하고, 이를 토대로 노화를 막는 치료법을 개발하기 위한 연구를 진행하고 있다.
ⓒGettyImages
생물학 분야 최고 권위의 국제학술지 ‘셀(Cell)’은
2013년 ‘노화의 특징(The Hallmarks of Aging)’이라는 제목의 논문을 발표하며 생물학적 노화의 9가지 특징을 정리했다.
이후 10년간 추가된 연구를 종합하여 지난 1월 ‘노화의 특징: 확장판’을 다시 펴냈다.
사이언스타임즈는 지난 기사(관련 기사 보러 가기 – 과학자들이 말하는 ‘늙음’의 진짜 원인_1편)에 이어서 노화의 생물학적 특징을 소개해보고자 한다.
노화의 원인 4: 단백질 항상성 상실
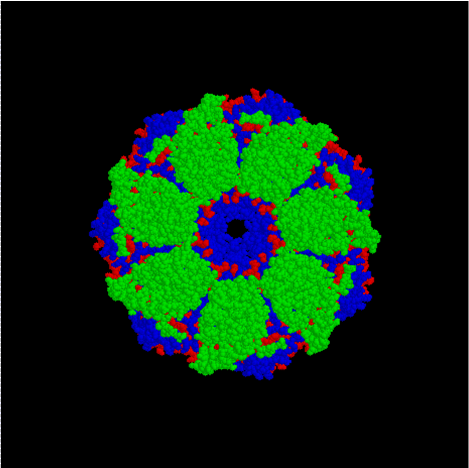
▲ 단백질이 정상적인 형태와 구조를 이루도록 돕는 ‘샤페론 단백질’의 구조 ⓒWikipedia
우리 몸속 단백질의 종류는 10만 종이 넘고, 무게로는
체중의 20% 정도다.
필요한 단백질은 새로 합성되고, 불필요하거나 변성된 단백질은 분해된다.
평균적으로 단백체(생체에 있는 단백질의 총집합)의 2~3%가 매일 교체된다.
단백질이 새로 합성되고, 활동하고, 분해되는 일련의 과정을 단백질 항상성이라고 한다.
즉, 문제가 있는 단백질의 세포 내 축적을 막고, 세포 내 단백질들을 지속해서 새로운 것으로 갱신시키는 과정이다.
하지만 노화에 따라 단백질 항상성은 떨어진다.
젊을 때는 피부에 생채기가 나도 빨리 회복되지만, 나이가 들수록 상처가 빨리 아물지 않는 것도 항상성과
깊은 관련이 있다.
단백질의 일생을 조금 더 자세히 설명해보겠다.
우선, 단백질이 정상적인 구조와 형태를 이루도록 ‘샤페론’이라는 단백질이 세포에서 활동한다.
불안정한 단백질이 생기면 그 구조가 안정되도록 도와주는 역할이다.
그러나 단백질이 잘못 만들어지면 빠르게 분쇄하여 배설되거나 재활용된다.
분해되는 방법은 두 가진데 ‘유비퀴틴’이라는 효소를 통해 하나하나의 단백질을 선별하는 과정과, ‘자가 포식’이라는 통해 제 기능을 하지 못하는 여러 단백질을 한꺼번에 포장하여 분해하는 방법이 있다.
노화에 따라 이 기능들은 모두 감소하기 때문에
손상된 단백질이 제거되지 못하고 쌓이면, 세포 분화를 방해하고 염증 및 세포 노화를 유발한다.
변성 단백질의 축적은 보통 나이에 비례하는데, 파킨슨병, 알츠하이머, 당뇨병 등 노화 관련 질병의 원인이 된다.
노화의 원인 5: 거대 자가 포식 장애
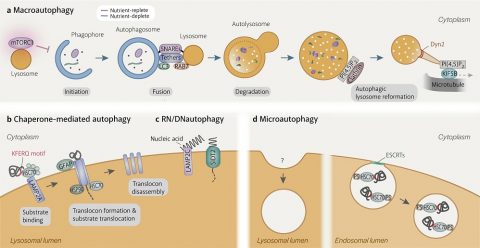
▲ 자가 포식은 세포 내 불필요하거나 기능이 고장 난 세포소기관을 분해하는 메커니즘으로 크게 거대 자가 포식(a), 샤페론 매개 자가 포식(b), 미세 자가 포식(c)으로 나뉜다.
노화에 따라 자가 포식 기능이 떨어지고, 이 때문에 노화 관련 질병이 유발된다.
ⓒCell Discovery
앞서 살펴본 것처럼, 자가 포식은 세포가 제 몸
일부를 스스로 잡아먹는 현상을 말한다.
그래서 자가 포식이라는 단어도 ‘스스로(auto)’와 ‘섭취(phagy)’를 뜻하는 그리스어를 합쳐 만들어졌다.
이 현상을 처음 발견한 오스미 요시노리 일본 도쿄공업대 명예교수는 지난 2016년 노벨 생리의학상을 수상하기도 했다.
거대 자가 포식 장애는 올해 ‘노화의 특징: 확장판’에 새롭게 추가된 원인이다.
그중에서도 거대 자가 포식(macroautophagy)는 자가
포식의 주된 유형으로, 단백질, 지방 및 세포 소기관을 포함한 세포 내용물을 리소좀 속에서 소화하는 과정이다.
망가진 물질만 분해하는 것은 아니다.
외부에서 영양소 공급이 끊기면 정상적인 제 몸의 일부마저 분해해 생존에 필요한 영양소로 사용한다.
다이어트 방법으로 거론되는 ‘간헐적 단식’은 이러한 자가 포식 작용을 근거로 사용한다.
여러 연구를 통해 노화가 진행되며 조직의 자가
포식 정도가 점차 줄어든다는 것이 확인됐다.
장수하는 쥐를 살펴보니 자가 포식이 활발하다는 결과도 있다.
또한, 자가 포식에 결함이 생기면 암, 심장병, 퇴행성 뇌 질환 같은 노화 관련 질병 발생에 직접적인 영향을 준다.
노화의 원인 6: 영양소 감지능력 저하

▲ 외부에서 흡수된 영양소의 정상 범위 농도를 인지하는 감지능력 저하도 노화의 대표적인 특징이다.
ⓒGettyImages
인슐린을 감지하면 세포는 포도당을 내부로 받아들여
혈당을 떨어뜨린다.
외부에서 흡수된 영양소에 대해 정상 범위의 농도를 인지하고 반응하는데, 노화가 진행되면 영양소 감지능력이 저하되며 적절한 대응을 하지 못한다.
즉, 영양소를 감지하는 능력이 둔해지는 것이다.
영양소 감지 능력이 떨어지면, 에너지를 만드는 미토콘드리아의 기능 감소를 유발해 세포의 노화가 촉진된다.
하지만 모순적이게도 영양소 감지 능력을 인위적으로
저하하면 오히려 수명을 연장할 수 있다는 가능성이 제시됐다.
성장호르몬과 인슐린과 유사한 분자구조를 가진 신진대사에 관여하는 호르몬인 인슐린 유사성장인자(IGF)는 나이가 듦에 따라 감소한다.
하지만 동물실험에서 유전자 조작을 통해 이들 수치를 인위적으로 낮추자, 세포 성장과 대사작용이 최소화하는 방어기제가 발동한 것이다.
이처럼 영양소 감지능력 저하는 노화된 개체의 공통적인 특징이지만, 오히려 노화를 막는 항노화 치료의 방법이 되기도 한다.
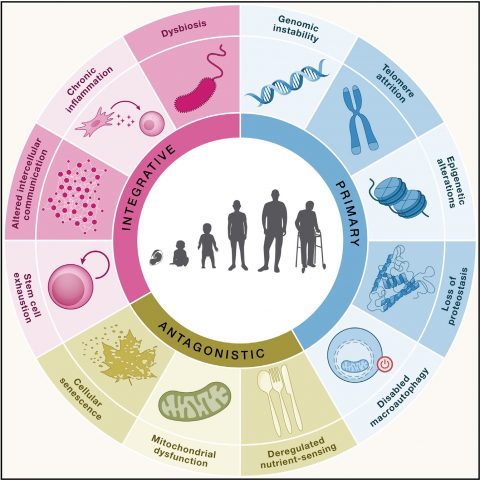
▲ 2023년 국제학술지 ‘Cell’이 제시한 노화의 12가지 특징. 이번 기사에서는 단백질 항상성 상실(Loss of proteostasis), 거대 자가 포식 장애(Disabled macroautophagy), 영양소 감지능력 저하(Deregulated nutrient-sensing)에 대해 다뤘다.
ⓒCell
과학자들이 말하는 ‘늙음’의 진짜 원인(3)
[과학자들이 말하는 ‘늙음’의 진짜 원인] 미토콘드리아 기능 장애, 세포 노화, 줄기세포 고갈

▲ 과학자들은 노화의 원인을 규명하고, 이를 토대로 노화를 막는 치료법을 개발하기 위한 연구를 진행하고 있다.
ⓒGettyImages
생물학 분야 최고 권위의 국제학술지
‘셀(Cell)’은 2013년 ‘노화의 특징(The Hallmarks of Aging)’이라는 제목의 논문을 발표하며 생물학적 노화의 9가지 특징을 정리했다.
이후 10년간 추가된 연구를 종합하여 지난 1월 ‘노화의 특징: 확장판’을 다시 펴냈다.
사이언스타임즈는 지난 기사(관련 기사 보러 가기 – 과학자들이 말하는 ‘늙음’의 진짜 원인(2))에 이어서 노화의 생물학적 특징을 소개해보고자 한다.
노화의 원인 7: 미토콘드리아 기능 장애
▲ 미토콘드리아는 노화에 따라 기능이 저하되며, 이 때문에 여러 노화 관련 질병이 유발된다.
ⓒGettyImages
세포의 에너지 공장인 미토콘드리아는
나이가 듦에 따라 자연스럽게 기능이 떨어진다.
미토콘드리아는 세포 내에서 에너지(ATP)를 만들어내는 과정에서 부산물로 활성산소도 만든다.
활성산소는 문자 그대로 반응성이 좋아 DNA나 단백질에 손상을 준다.
노화에 따라 미토콘드리아 기능이 저하되며 활성산소 생성량이 늘어나고, 늘어난 활성산소가 다시 미토콘드리아 기능 저하를 비롯한 전반적인 세포 내 손상을 유발한다.
오랫동안 미토콘드리아에서 만들어지는 활성산소가 노화와 노화 관련 질병에 영향을 준다고 알려져 왔다.
그런데 최근에는 활성산소를 마냥 노화의
‘악’으로만 보긴 어렵다는 증거들이 나타나고 있다.
예쁜 꼬마선충 실험에서 활성산소의 증가가 오히려 수명을 늘린다는 의외의 결과가 나온 것이 신호탄이었다.
이후 쥐 실험에서도 유전자 조작으로 미토콘드리아에서 발생하는 활성산소와 산화 손상을 늘려도 노화가 가속되지 않았다.
일련의 연구에 따라 최근에는 세포의
손상을 보수하기 위해 활성산소량이 증가하는 생존 신호로 보는 추세다.
하지만 활성산소량이 역치를 넘어서면 손상을 경감시키는 역할이 아니라, 오히려 세포를 공격하는 신호가 된다.
한편, 미토콘드리아 자체의 손상도 노화에 영향을 미치며, 노화에 따라 미토콘드리아의 에너지 생산 효율이 감소하기도 한다.
노화의 원인 8: 세포 노화
▲ 인간 피부 세포의 모습. ⓒFlickr
세포는 생장하고 분열하는 주기를 가진다.
하지만 세포 노화가 일어나면 이 주기를 멈춘다.
한 연구에서는 쥐 실험에서 장기 별로 세포 노화 상태를 측정했다.
간세포에서 젊은 쥐의 8%, 늙은 쥐의 17%의 세포가 세포노화 상태였다.
피부와 간, 비장에서는 간과 비슷한 수준의 세포 노화가 발생했다.
그러나 심장, 신장, 근육에서는 나이에 따른 세포 노화 증가 현상이 발견되지 않았다.
세포 노화가 모든 조직에서 나타나는 현상은 아니라는 의미다.
세포 노화의 주요 목적은 면역 반응을
유도하여, 손상이 일어난 세포가 전파되는 것을 막는 것이다.
가령, 암세포가 될 가능성이 있는 세포를 제거하기 위한 보상으로 세포 노화가 진행된다.
하지만 노화가 발생한 세포를 제거된 만큼, 새로운 세포가 보충되며 항상성이 유지돼야 한다.
노화된 개체에서는 항상성 유지 능력이 떨어져, 세포 노화가 발생한 세포가 축적된다.
노화 세포의 측정은 주변 세포들의
비정상적인 분화를 유도하고, 더 나아가 다양한 조직의 기능 장애를 촉진할 수 있다.
손상 복구 능력이 떨어지는 늙은 개체에서는 조직의 재생 능력이 떨어지기 때문에 만성적인 염증이 유발되기도 한다.
활성산소와 마찬가지로 적당한 세포 노화는 오히려 수명을 연장하는 작용을 한다.
동물실험에서 노화 세포를 제거했을 때 나이 관련 질병들이 지연된다는 결과를 보기도 했다.
초기에는 이롭지만, 만성이 되면 불리해진다는 의미다.
노화의 원인 9: 줄기세포 고갈
▲ 쥐 신경 줄기세포의 모습. ⓒFlickr
여러 말단세포로 분화하는 능력을 갖춘
줄기세포의 고갈은 여러 노화 관련 손상의 통합적인 결과이다.
줄기세포 기능 저하는 모든 나이 든 개체에서 공통으로 나타난다.
젊은 쥐에 비해 노화된 쥐는 줄기세포의 활성이 떨어지고, 세포분열도 더 적게 한다.
또, 성장, 발달 및 신진대사를 담당하는 뇌 부위인 시상하부에 있는 줄기세포가 몸의 노화 속도를 관리 및 통제한다고 보고되기도 했다.
줄기세포의 분열 능력 감퇴도 문제지만, 과도한 분열도 노화의 원인이 된다.
과도하게 분열되면 결국 줄기세포의 고갈을 초래하여 조로증이 발생한다.
줄기 세포의 기능 저하가 초래하는
현상은 세포 외에서도 영향을 미친다.
젊은 쥐에서 추출한 근육 줄기세포를 조로증을 겪는 쥐에게 이식한 연구에 따르면, 조로증 쥐의 수명이 늘어난 것은 물론 근육 외 다른 기관에서 발생한 퇴행성 질환도 개선됐다.
줄기세포가 특정 인자들을 세포 외로 분비하여 전체적인 몸의 상태에 영향을 미치는 것이다.
젊은 쥐와 늙은 쥐의 혈관을 이어 붙인 연구에서도 젊은 쥐의 분비 인자에 의해 늙은 쥐의 다양한 줄기세포 기능들이 개선됐다.
줄기세포 고갈은 다양한 노화 관련
손상의 통합적인 결과다.
줄기세포의 수 감소는 노화를 일으키는 장본인이지만, 손실 결과는 돌이킬 수 없다.
이러한 점에서 최근에는 줄기세포를 회춘시켜 노화로 말미암은 문제를 해결하기 위한 연구가 활발히 진행되고 있다.
‘리파마이신’으로 대표되는 약물을 활용하거나, 줄기세포 또는 이들이 생산하는 분자를 보충하여 몸 전체 노화의 여러 측면을 늦추거나 심지어 역전시키려는 시도다.
▲ 2023년 국제학술지 ‘Cell’이 제시한 노화의 12가지 특징. 이번 기사에서는 미토콘드리아 기능 장애(Mitochodrial dysfinction), 세포 노화(Cellular senescence), 줄기세포 고갈(Stem cell exhaustion)에 대해 다뤘다.
ⓒCell
과학자들이 말하는 ‘늙음’의 진짜 원인(4)
[과학자들이 말하는 ‘늙음’의 진짜 원인] 세포 간 소통 변화, 만성 염증, 장내 세균 불균형

▲ 과학자들은 노화의 원인을 규명하고, 이를 토대로 노화를 막는 치료법을 개발하기 위한 연구를 진행하고 있다.
ⓒGettyImages
생물학 분야 최고 권위의 국제학
지 ‘셀(Cell)’은 2013년 ‘노화의 특징(The Hallmarks of Aging)’이라는 제목의 논문을 발표하며 생물학적 노화의 9가지 특징을 정리했다.
이후 10년간 추가된 연구를 종합하여 지난 1월 ‘노화의 특징: 확장판’을 다시 펴냈다.
사이언스타임즈는 지난 기사(관련 기사 보러 가기 – 과학자들이 말하는 ‘늙음’의 진짜 원인_1편,2편,3편)에 이서 노화의 생물학적 특징을 소개해보고자 한다.
노화의 원인 10: 세포 간 소통 변화

▲ 세포 내부에서 일어나는 변화를 넘어 세포 간 소통 변화도 노화와 밀접한 관련이 있다.
ⓒGettyImages
사람의 몸은 약 30조 개의
세포로 구성된다.
우리 은하계에 있는 별보다 많은 수다.
이들 세포는 세포막을 통해 전기적 신호를 보내면서 서로 의사소통을 한다.
하지만 정밀한 소통 시스템에 문제가 생기면 노화가 진행된다.
즉, 세포 내부에서 일어나는 변화뿐 아니라 세포 간 소통의 변화도 노화와 밀접한 관련이 있다.
대표적인 반응이 염증반응이다.
외부에서 병원체가 침입하면 세포 간 소통을 통해 이 소식을 알리고, 면역세포가 병원체에 대응하기 맞서며 염증이 생긴다.
나이가 들면 세포 간 소통이 잘못 조절되어 염증반응이 증가하고, 병원균이나 악성 세포에 대항하는 면역 방어 능력이 감소한다.
또, 노화로 말미암은 변화가 하나의 조직에서 일어나면 세포 간 소통 때문에 다른 조직에도 문제를 일으킨다.
노화한 세포가 주변 세포의 노화를 유도한다는 것이다.
이를 역 이용하여 하나의 조직에
수명을 늘리는 조작을 가하면 세포 간 소통을 통해 다른 조직의 노화 속도도 늦출 수 있다.
노화와 젊음이 ‘전이’될 수 있다는 의미다.
여러 동물실험을 통해 젊은 피의 회춘 효과가 입증됐으며, 반대로 ‘늙은 피’를 투입한 쥐의 노화 속도가 빨려졌다는 연구결과도 있다.
노화의 원인 11: 만성 염증
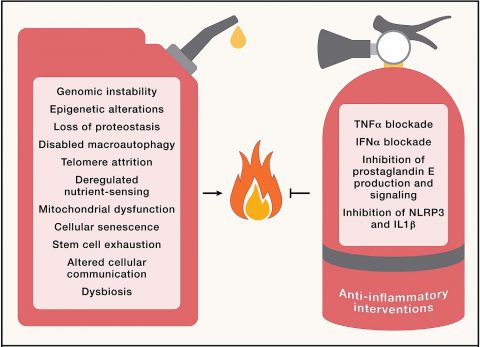
▲ 만성 염증은 노화를 유발하는 여러 요인의 복합적인 결과로 발생한다.
오른쪽 소화기에는 염증 반응 제어를 통해 노화를 막으려는 여러 시도가 명시되어 있다.
ⓒCell
세균이나 바이러스가 체내에
들어오면 면역반응을 일으키며 염증이 생긴다.
시간이 지나면 자연스럽게 없어지는 ‘급성염증’과 달리, 없어지지 않고 계속 생겨나는 염증을 ‘만성 염증’이라고 부른다.
만성 염증은 가랑비에 옷이 젖듯 몸을 천천히 망가뜨린다.
혈관을 타고 몸속 곳곳을 돌아다니면서 신체를 손상하고, 암 발병률을 높인다.
또 뇌세포를 파괴해 우울증, 알츠하이머성 치매를 일으키기도 한다.
‘기력이 약해졌다’ 표현을 자주 듣고는 하는데, 이 역시 만성 염증 때문이다.
만성 염증은 사람을 허약하게 만들어 ‘건강 장수’를 어렵게 하고,
빨리 늙게 한다.
노화는 올해 발표한 ‘확장판’에서
새롭게 추가된 특징이다.
이전에도 과학자들은 염증이 노화의 원인이 되리라 추측해 왔으나 증거를 찾지 못했었는데, 10년의 연구를 보태어 노화의 주요 원인 중 하나로 추가됐다.
노인들은 젊은이들보다 약 2~4배 정도 염증 전달 물질이 증가한다.
과도한 염증 반응은 오히려 독이 된다.
염증 물질이 증가하면 질병에 걸리는 비율과 사망률이 높아진다.
실제로, 100세 이상 장수자의 혈액을 조사했을 때 염증 물질이 상대적으로 적고, 염증 반응이 드물게 일어나는 유전자를 가진 경우가 많았다.
이를 역으로 이용하여 염증
제어를 통해 노화를 억제할 수 있는 시도도 진행되고 있다.
염증세포가 분비하는 ‘종양괴사인자(TNF-α)’를 조절하거나, 만성 염증을 일으키는 면역체계를 제어하는 분자(NLRP3)의 스위치를 꺼버리는 식이다.
노화의 원인 12: 장내 세균 불균형
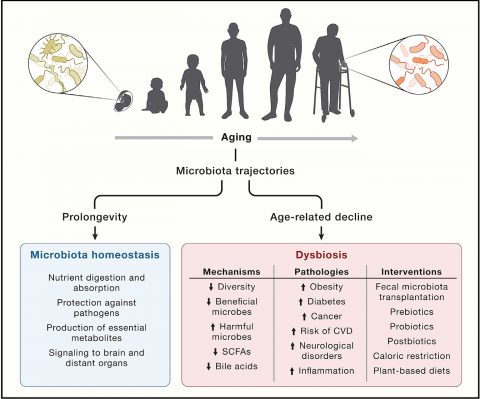
▲ 인간의 장내 미생물은 노화 과정에서 크게 변화하며, 노화에 따라 생태적 다양성이 전반적으로 감소한다.
ⓒCell
장내미생물 역시 이번 논문에서
새롭게 추가된 노화의 특징이다.
장내 미생물은 인체를 구성하는 필수 요소로 최근에서야 그 기능과 역할의 중요성이 높아지고 있다.
사람마다 다르지만, 대변 1g에는 약 1,000종류의 장내미생물이 1,000억~100조 개가량 있다.
장내미생물을 모두 합친 무게는 1~1.5kg으로 간 무게와 비슷하다.
그만큼 숙주의 전반적인 건강에 미치는 영향이 크다.
장내미생물의 노화와의 연관성이
밝혀진 건 최근 일이다.
장내 미생물은 숙주의 인종, 식습관, 생활 습관, 환경 조건에 따라 달라지기 때문에 노화와의 연관성을 규명하기가 어려웠다.
2021년 미국 연구진은 18~101세의 참가자 9,000여 명의 장내미생물을 분석하며 강력한 증거를 제시했다.
연구에 따르면 중년에서 말년으로 나이가 들어감에 따라 핵심 장내 미생물의 다양성은 점차 줄었지만, 사람마다 고유한 특성을 갖추는 것으로 나타났다.
하지만 건강하지 못한 사람들에게서는 고유성이 나타나지 않았다.
이런 점을 이용해 장내미생물은
수명을 예측하는 요소로도 사용하려는 시도도 진행되고 있다.
노화에 따른 장내 미생물 양상 변화는 40~50세의 중년에 시작된다.
건강한 노인과 그렇지 않은 노인의 장내 미생물 양상이 다르다는 점을 이용하면 건강하게 늙을지 여부를 판단할 수 있다.
한편, 장내 미생물을 이용해
노화를 막으려는 연구도 진행되고 있다.
대변을 이식해 회춘을 노리는 시도다.
한 연구에서 청년 물고기의 대변을 중년 물고기에게 먹였더니 수명이 무려 41%나 늘었다는 연구 결과도 나왔다.
노화에 따라 장내 미생물의 다양성이 상실되며, 유해균들이 장내 생태계를 압도하게 되는데, 젊은 대변을 이식해 장 환경을 재구성하면 수명을 연장할 수 있는 것이라고 연구진은 설명했다.
▲ 2023년 국제학술지 ‘Cell’이 제시한 노화의 12가지 특징. 마지막 편에서는 세포 간 소통 변화(Altered intercellular communication), 만성 염증(Chronic inflammation), 장내 세균 불균형(Dysbiosis)에 대해 다뤘다.
ⓒCell
